我们了解超分辨技术之前,需要先了解什么是分辨率。我们经常听到的分辨率一般都是指的光学分辨率,它反映的是解析物体细节的能力。
阿贝衍射极限的提出让人们意识到光学显微镜的分辨率是不能无限提升的。
光学系统的分辨率极限可以表示为:
δ=λ/2nsin(α)
其中λ为光的波长,n为浸液的折射率, α为物方孔径角。这个光学分辨极限的典型值大约为200nm.
也就是说,一个光学系统想要实现200nm以内物体细节的分辨,单单靠传统成像的方式,已经不行了。
这个时候需要借助生物荧光,压缩点扩散函数PSF。是的,就是下面这三位获得了2014年的诺贝尔化学奖,从此,让光学显微镜步入了纳米时代。

这里进入正题:
如何实现200nm以内的分辨率?目前的主要技术手段有以下三种方式:
第一种方式:通过受激辐射损耗(STED)压缩衍射艾里斑;
利用荧光分子的受激辐射损耗机制,通过产生甜甜圈(doughnut)状的损耗光来消耗能够发射荧光的分子。这样一来,只有位于环形光束中心的分子(那里的损耗激光强度接近于零)才能发出荧光,从而在样品上形成一个远小于衍射极限的荧光发射区域。通过将激发光与损耗光同步扫描样品所在平面,艾里斑周围的光被甜甜圈的环形激光猝灭,即可获得样品的超分辨图像,原理及效果图如下:
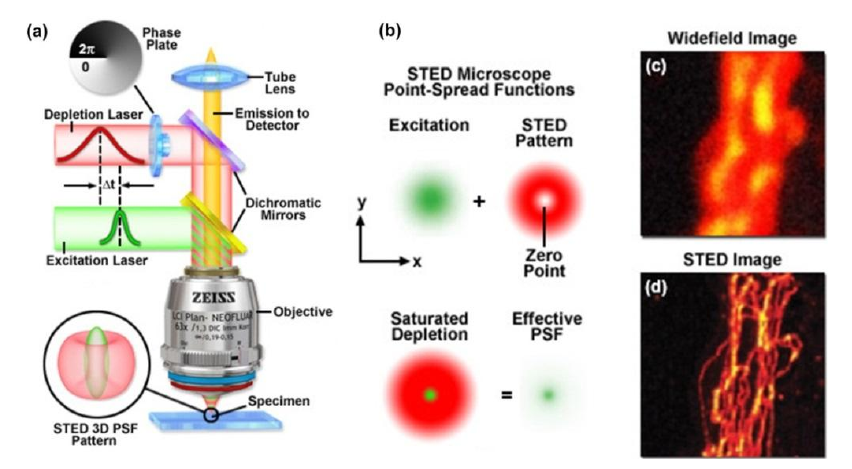
这里值得注意的是:STED属于点扫描成像,因此空间分辨率与激发光斑的尺寸密切相关,目前STED分辨率可达5.8nm(可用于活体成像)。
第二种方式:孤立单分子荧光,通过相机定位计算荧光点的中心位置即单分子定位显微技术(SMLM)
简单来说,在超分辨采集过程中,利用相机采集的图像计算单分子的位置,并将这些位置信息累积起来,进而得到最终的超分辨图像。
实现方式:在不同的时间点随机激活衍射极限区域(有效视场)之内的单个荧光分子来达到分离荧光分子的目的,对于空间上孤立的单个分子,它的位置可以通过定位它在图像上的中心位置来确定,定位精度可达纳米甚至亚纳米级别。在下一时刻激发孤立荧光分子时,上一时刻激发过的孤立荧光分子会被关闭或者漂白。如此多次循环直至这些相机定位结果能够构成一幅完整的超分辨图像。
这种方式需要拍摄大量的照片,耗时比较长。下面是原理及效果图:
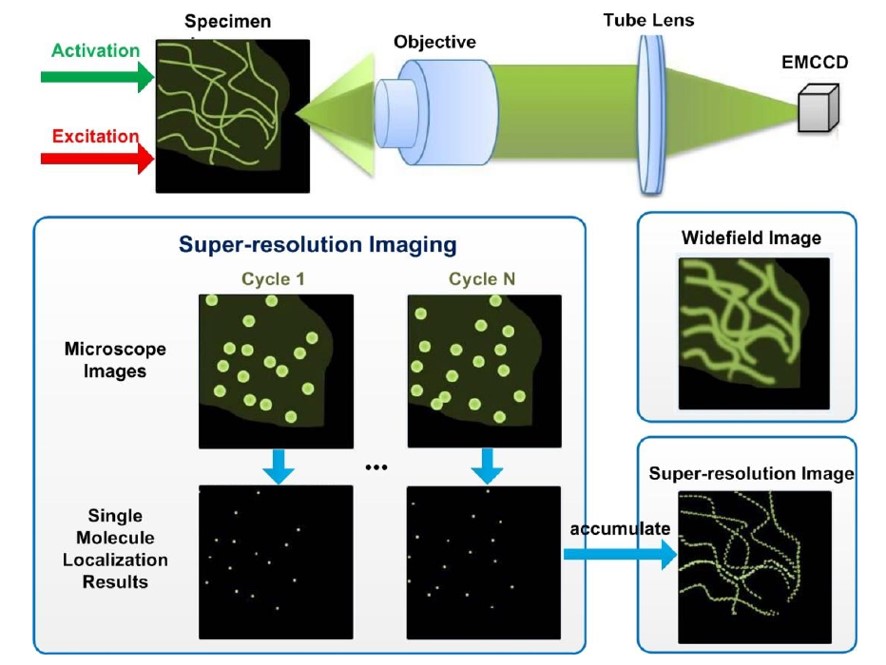
通过使用可在激活与猝灭之间切换的荧光蛋白或者染料来实现荧光分子的随机激发,这种方式可实现20nm的超分辨。
这种方式,本质上其实也同样采用了压缩PSF的方式,相机定位中心位置后,边缘位置的荧光会被人为舍弃。只是和第一种方式相比实现压缩PSF点扩散函数的方式不同而已。
第三种方式:结构光照明SIM技术,使用频谱搬移(说白了,就是莫尔条纹的原理)
SIM利用条纹状的结构照明光照明样品,将样品的高频信息转化为能被物镜收集的低频信息,从而达到扩展样品频谱的目的,最终使系统的分辨率得到提升。由于衍射的存在,条纹结构照明光的空间周期无法低于衍射极限,因此线性SIM只能将分辨率扩展到衍射极限的2倍。与直接从原始数据生成超分辨率图像的STED不同,SIM需要额外的后期大量的图像处理来获得最终图像。
从本质上讲,构建一张超分辨的照片,需要不同方向不同相位角的结构光照明(比如2个方向,4个相位角,这就是8张照片)才能实现一张超分辨照片的重构。
下面是结构光超分辨显微术的原理及效果图:
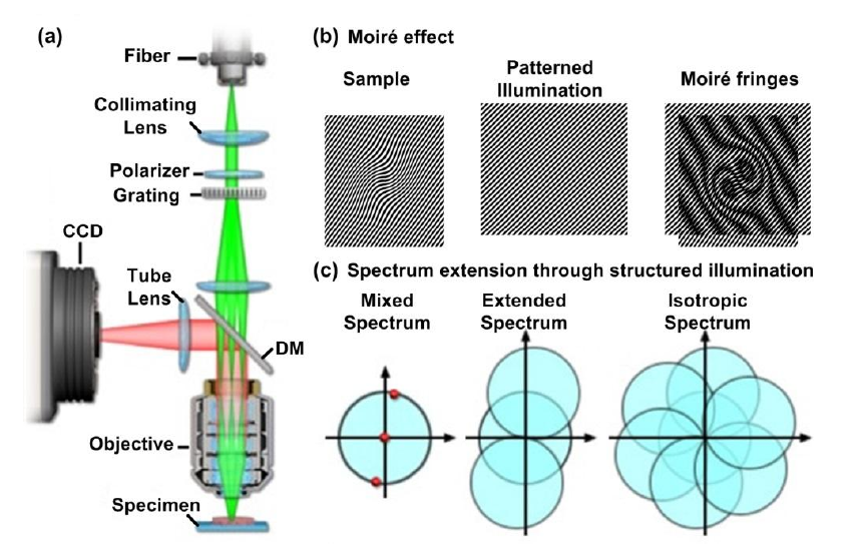
这种方式,大约可以实现100nm的分辨率,因为本质上采用的是莫尔条纹的原理。
总结:上述超分辨成像技术中,基于特殊照明的超分辨方法STED、以及基于单分子定位的超分辨方法(SMLM),都是非衍射受限的,因此理论上这些成像方法的分辨率可以无限提升。但在实际应用中,影响分辨率的因素有很多,例如激发方案和探测方案的选取,荧光探针的光物理特性,荧光探针的大小,以及探针的标记密度和采样率等等。在生物成像中,这些方法的分辨率通常在10-100nm范围内,仅在某些特殊情况下可达10nm以下。


